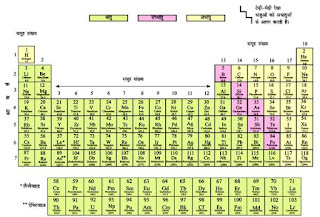
Class 10 Science Chapter 3 | Hindi Medium | धातु और आधातु
विज्ञान कक्षा 10
तत्वों को उनके
गुणर्धर्मों के आधार पर धातु, अधातु तथा उपधातु में
वर्गीकृत किया जाता है। वर्तमान में 118 तत्व ज्ञात है जिनमें
से लगभग 90 धातु,
22 अधातु तथा कुछ उपधातु है।
धातुओं के उदाहरण-
आयरन, कापर एल्यूमिनियम, कैलिशयम, मैग्नीशियम, सोडियम, लेड, जिंक पारा आदि
अधातुओं के उदाहरण-
हाइड्रोजन, आक्सीजन, नाइट्रोजन, सल्फर, क्लोरीन, आयोडीन आदि।
धातुओं के भौतिक
गुणधर्म-
- धात्विक
चमक- शुद्ध धातु की सतह चमकदार होती है,
धातु के इस गुण को धात्विक चमक कहते हैं।
- कठोरता
- धातुएँ सामान्यतः कठोर होती है। लकिन सोडियम,
लिथियम,
पोटैशियम नरम धातुएँ हाेती है, इन्हें चाकू से काटा जा सकता है।
- अवस्था-
धातुएं कमरे के ताप पर ठोस अवस्था में पाई जाती है । लेकिन पारा (मर्करी ) एक
ऐसी धातु है जो ठोस अवस्था में पाई जाती है।
- आघातवर्ध्यता
- कुछ धातुओं को पीटकर पतली चादर बनाया जा सकता है , धातुओं के इस गुण को आघातवर्ध्यता कहते हैं।
- तन्यता-
धातुओं को खींच कर लम्बी तार बनाया जा सकता है,
धातुओं की यह क्षमता तन्यता कहलाती है।
- उष्मा
तथा विद्युत की चालकता- धातुएँ सामान्यतः उष्मा तथा विद्युत की सुचालक होती
हैं। लेकिन लैड और मर्करी उष्मा और विद्युत के कुचालक होती है।
- सोनोरस
(ध्वानिक)- समान्यतः धातुएँ कठोर सतह के साथ टकराकर आवाज पैदा करती है । ऐसी
धातुएँ सोनोरस कहलाती है।
अधातुओं के भौतिक गुण
-
- भौतिक
अवस्था- अधातुएँ ठोस या गैसीय रूप में पाई जाती है । लेकिन ब्रोमीन एक ऐसी
अधातु जो तरल अवस्था में पाई जाती है।
- चमक-
सामान्यतः अधातुएँ चमकदार नहीं होती । आयोडीन एक चमकीली अधातु हैI
- कठोरता-
अधातुएँ अधिकतर कठोर नहीं होती। लेकिन कार्बन अधातु का अपररूप हीरा प्रकृति
का सबसे कठोर पदार्थ है।
- अवस्था – आधातुएँ ठोस या गैसीय अवस्था में पाई जाती हैं।
केवल ब्रोमीन आधातु तरल अवस्था में पाई जाती है।
- आघातवर्ध्यता – आधातुएँ आघातवर्ध्य नहीं होती।
- तन्यता – आधातुएँ तन्य नहीं होती।
- ऊष्मा व विद्युत की चालकता – सामान्यत: आधातुएँ ऊष्मा व
विद्युत की कुचालक होती है। लेकिन ग्रेफ़ाइट (कार्बन का अपरूप) ऊष्मा व
विद्युत का सुचालक है।
- सोनोरस (ध्वानिक)- आधातुएँ
ध्वानिक नहीं होती हैं।
प्रयोग द्वारा सिद्ध करना कि धातुएँ ऊष्मा की सुचालक होती हैं।
आवश्यक सामग्री- एक स्टैंड, धातु की छड़, मोम, पिन, बर्नर आदि।
2. क्लैंप की
मदद से इस तार को चित्रानुसार स्टैंड पर लगाओ।
3. तार के खुले सिरे पर मोम की सहायता से एक पिन चिपकाओ।
4. ऐलुमिनियम
की छड़ को गर्म करो। |
प्रेक्षण- कुछ देर
बाद धातु की छड़ पर लगी पिन नीचे गिर जाएगी।
निष्कर्ष/परिणाम- धातुएँ
ऊष्मा की सुचालक होती हैं।
प्रयोग द्वारा सिद्ध करना कि धातुएँ विद्युत की सुचालक होती हैं-
आवश्यक सामग्री- विभिन्न
धातुओं की तार के नमूने, बल्ब, बैटरी, कुंजी, क्लिंप, संयोजी तार
आदि।
2. क्लिप A, B के बीच दिए गए धातु की तार का टुकड़ा
लगाओ।
3. अब कुंजी
को ऑन करो।
4. बल्ब की
स्थिति नोट करो।
5. यह
प्रक्रिया अलग-अलग धातु की तारों से दोहराओ।
प्रेक्षण- बल्ब जलने
लगता है।
निष्कर्ष/परिणाम- धातुएँ
विद्युत की सुचालक होती हैं।
प्रश्न
(1) ऐसी धातु का उदाहरण दीजिए जो –
(i) कमरे के ताप पर द्रव होती है।
(ii) ऊष्मा की सबसे अच्छी चालक होती है।
(iii) चाकू से आसानी से काटा
जा सकता है।
(iv)
ऊष्मा को कुचालक होती है।
(2) आघातवर्थ्य तथा तन्य का अर्थ बताइए।
धातुओं के रासायनिक गुणधर्म
धातुएँ ऑक्सीजन के साथ मिलकर संगत धातु के ऑक्साईड बनाती हैं।
धातु + ऑक्सीजन → धातु ऑक्साइड
उदाहरण-
1.
जब कॉपर को वायु की उपस्थिति में गर्म किया जाता है तो यह ऑक्सीजन के साथ मिलकर काले रंग का कॉपर (II) ऑक्साइड बनाता है।
2Cu
+ O2 → 2CuO
कॉपर
कॉपर (II) ऑक्साइड
2.
इसी प्रकार ऐलुमिनियम ऑक्सीजन के साथ मिलकर ऐलुमिनियम ऑक्साइड प्रदान करता है।
4AI
+ 3O2 → 2Al2O3
ऐलुमिनियम
ऐलुमिनियम ऑक्साइड
Note:
ऑक्सीजन के साथ सभी धातुएँ एक ही दर से अभिक्रिया
नहीं करती हैं। विभिन्न धातुएँ ऑक्सीजन के साथ विभिन्न अभिक्रियाशीलता प्रदर्शित
करती हैं।
1.
पोटेशियम तथा सोडियम जैसी कुछ धातुएँ इतनी तेजी से अभिक्रिया करती
हैं कि खुले में रखने पर आग पकड़ लेती हैं। इसलिए, इन्हें सुरक्षित रखने तथा आकस्मिक आग को रोकने के
लिए किरोसिन तेल में डुबो कर रखा जाता है।
2.
सामान्य ताप पर मैग्नीशियम, ऐलुमिनियम, जिंक, लेड आदि जैसी धातुओं की सतह पर ऑक्साइड की पतली परत चढ़ जाती है। ऑक्साइड
की यह परत धातुओं को पुनः ऑक्सीकरण से सुरक्षित रखती है।
3.
गर्म करने पर आयरन का दहन तो नहीं होता है लेकिन जब बर्नर की ज्वाला
में लौह चूर्ण डालते हैं तब वह तेजी से जलने लगता है।
4.
कॉपर का दहन तो नहीं होता है लेकिन गर्म धातु पर कॉपर (II) ऑक्साइड की काले रंग की परत चढ़
जाती है।
5.
सिल्वर एवं गोल्ड अत्यंत अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया
नहीं करते हैं।
उभयधर्मी ऑक्साइड
ऐसे धातु ऑक्साइड जो अम्ल तथा क्षारक दोनों से
अभिक्रिया करके लवण तथा जल प्रदान करते हैं, उभयधर्मी ऑक्साइड कहलाते हैं। उदाहरण: ऐलुमिनियम
ऑक्साइड, जिंक ऑक्साइड।
अम्ल तथा क्षारक के साथ ऐलुमिनियम ऑक्साइड निम्न
प्रकार से अभिक्रिया करता है।
Al2O3 + 6HCI → 2AICI3 + 3H2O
Al2O3+ 2NaOH → 2NaAlO2 + H2O
सोडियम ऐलुमिनेट
Note:
अधिकांश धातु ऑक्साइड जल में अघुलनशील हैं लेकिन
इनमें से कुछ जल में घुलकर क्षार प्रदान करते हैं। सोडियम ऑक्साइड एवं पोटेशियम
ऑक्साइड निम्न प्रकार से जल में घुलकर क्षार प्रदान करते हैं:
Na2O(s) + H2O(l) → 2NaOH(aq)
K2O(s) + H2O(l) → 2KOH(aq)
ऐनोडीकरण (Anodising):
ऐनोडीकरण (Anodising) ऐलुमिनियम पर मोटी ऑक्साइड की परत बनाने की
प्रक्रिया है। वायु के संपर्क में आने पर ऐलुमिनियम पर ऑक्साइड की पतली परत का
निर्माण होता है।
ऐलुमिनियम ऑक्साइड की परत इसे संक्षारण से बचाती
है। इस परत को मोटा करके इसे संक्षारण से अधिक सुरक्षित किया जा सकता है।
ऐनोडीकरण के लिए ऐलुमिनियम की एक साफ़ वस्तु को
एनोड बनाकर तनु सल्फ्यूरिक अम्ल के साथ इसका विद्युत अपघटन किया जाता है। ऐनोड़ पर
उत्सर्जित ऑक्सीजन गैस ऐलुमिनियम के साथ अभिक्रिया करके ऑक्साइड की एक मोटी परत
बनाती है। इस ऑक्साइड की परत को आसानी से रैंगकर ऐलुमिनियम की आकर्षक वस्तुएँ बनाई
जा सकती हैं।
धातुओं की जल के साथ अभिक्रिया
धातुएँ जल के साथ अभिक्रिया करके हाइड्रोजन गैस
तथा धातु ऑक्साइड उत्पन्न करती हैं। जो धातु ऑक्साइड जल में घुलनशील हैं, जल में घुलकर धातु हाइड्रॉक्साईड
प्रदान करते हैं। लेकिन सभी धातुएँ जल के साथ अभिक्रिया नहीं करती हैं।
धातु + जल → धातु
ऑक्साइड + हाइड्रोजन
धातु ऑक्साइड + जल → धातु
हाइड्रॉक्साइड
पोटैशियम एवं सोडियम जैसी धातुएँ ठंडे जल के साथ तेज़ से
अभिक्रिया करती हैं। सोडियम तथा पोटेशियम की अभिक्रिया तेज़ तथा ऊष्माक्षेपी होती
है कि इससे उत्सर्जित हाइड्रोजन तत्काल प्रज्ज्वलित हो जाती है।
2K(s) + 2 H2O(l)
→ 2KOH(aq) + H2(g) + ऊष्मीय
ऊर्जा
2Ma(s) + 2 H2O(l)
→ 2NaOH(aq) + H2(g) + ऊष्मीय
ऊर्जा
जल के साथ कैल्सियम की अभिक्रिया थोड़ी धीमी
होती है। यहाँ उत्सर्जित ऊष्मा हाइड्रोजन के प्रज्ज्वलित होने के लिए पर्याप्त
नहीं होती है।
Ca(s) +2 H2O(l) → Ca(OH)2 (aq) + H2(g)
क्योंकि उपरोक्त अभिक्रिया में उत्पन्न हाइड्रोजन
गैस के बुलबुले कैल्सियम धातु की सतह पर चिपक जाते हैं। अत: कैल्सियम तैरना प्रारंभ
कर देता है।
मैग्नीशियम शीतल जल के साथ अभिक्रिया नहीं करता है परंतु गर्म
जल के साथ अभिक्रिया करके वह मैग्नीशियम हाइड्रॉक्साइड एवं हाइड्रोजन गैस
उत्पन्न करता है। चूँकि हाइड्रोजन गैस के बुलबुले मैग्नीशियम धातु की सतह से चिपक
जाते हैं। अतः यह भी तैरना प्रारंभ कर देते हैं।
ऐलुमिनियम, आयरन तथा जिक जैसी धातुएँ न तो शीतल जल के साथ और न ही गर्म जल
के साथ अभिक्रिया करती हैं। लेकिन भाप के साथ अभिक्रिया करके यह धातु
ऑक्साइड तथा हाइड्रोजन प्रदान करती हैं।
2Al(s) + 3H2O(g) → Al2O3(s)
+ 3H2(g)
3Fe[s] + 4H2O(g) → Fe3O4(s)
+4H2(g)
लेड, कॉपर, सिल्वर तथा गोल्ड जैसी
धातुएँ जल के साथ बिलकुल अभिक्रिया नहीं करती हैं।
धातुओं की अम्लों के साथ अभिक्रिया:
धातुएँ अम्ल के साथ अभिक्रिया करके संगत लवण तथा
हाइड्रोजन गैस प्रदान करती हैं।
धातु + तनु अम्ल → लवण +
हाइड्रोजन
Fe + 2HCl → FeCl2 + H2
Mg + 2HCl → MgCl2 + H2
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + H2
नोट:
·
यहाँ अभिक्रियाशीलता इस क्रम में घटती है; Mg > Al > Zn> Fe
·
Cu, Ag, Hg तनु अम्लों के साथ अभिक्रिया नहीं करते।
एक्वा रेजिया - Aquct regia (रॉयल जल का लॅटिन शब्द) 3:1 के अनुपात में सांद्र हाइड्रोक्लोरिक अम्ल एवं सांद्र नाइट्रिक अम्ल का
ताँजा मिश्रण होता है। यह गोल्ड को गला सकता है जबकि दोनों में से किसी अम्ल में
अकेले यह क्षमता नहीं होती है। ऐक्वा रेजिया भभकता द्रव होने के साथ प्रबल
संक्षारक है। यह उन अभिकर्मकों में से एक है जो गोल्ड एवं प्लैटिनम को गलाने में
समर्थ होता है।
धातुओं की अन्य धातु लवणों के साथ अभिक्रिया
धातु (A) + (B) का लवण विलयन → (A) का लवण विलयन + धातु (B)
अधिक अभिक्रियाशील धातुएँ अपने से कम क्रियाशील
धातुओं को उनके यौगिक के विलयन से विस्थापित करती हैं। यह धातुओं की सक्रियता
श्रेणी पर आधारित है।
सक्रियता श्रेणी: सक्रियता श्रेणी वह सूची है जिसमें धातुओं को
क्रियाशीलता के अवरोही क्रम में व्यवस्थित किया जाता है।
K
|
पोटैशियम
|
सबसे अधिक अभिक्रियाशील
|
Na
|
सोडियम
|
¯
¯
घटती अभिक्रियाशीलता
¯
¯
|
Ca
|
कैल्सियम
|
|
Mg
|
मैग्नीशियम
|
|
Al
|
ऐलुमिनियम
|
|
Zn
|
जिक
|
|
Fe
|
आयरन
|
|
Pb
|
लेड
|
|
H
|
हाइड्रोजन
|
|
Cu
|
कॉपर (तावा)
|
|
Hg
|
मर्करी (पारद)
|
|
Ag
|
सिल्वर
|
|
Au
|
गोल्ड
|
सबसे कम अभिक्रियाशील
|
धातुओं की अधातुओं के साथ अभिक्रिया:
तत्वों की
अभिक्रियाशीलता को, संयोजकता कोश को
पूर्ण करने की प्रवृत्ति के रूप में समझा जा सकता है।
धातु के परमाणु अपने
संयोजकता कोश को पूर्ण करने के लिए एक या अधिक इलेक्ट्रॉनों का त्याग करके धनायन
बनाते हैं। तथा आधातु संयोजकता कोश को पूर्ण करने के लिए एक या अधिक इलेक्ट्रॉन
ग्रहण करके ऋणायन बनाते हैं। ये विपरीत आवेशित आयन एक दूसरे को आकर्षित करते हैं
तथा मजबूत स्थिर वैद्युत बल मेन बंधकर आयनिक यौगिक बनाते हैं।
उदाहरण: सोडियम
क्लोराइड का निर्माण
MgCl2 का निर्माण :
आयनिक यौगिकों के गुणधर्म
आयनिक यौगिकों के सामान्य गुणधर्म निम्नलिखित है-
(i) भौतिक प्रकृतिः धन एवं ऋण आयनों के बीच मजबूत आकर्षण बल के कारण
आयनिक यौगिक ठोस एवं थोड़े कठोर होते हैं। ये यौगिक सामान्यत: भंगुर होते हैं तथा
दाब डालने पर टुकड़ों में टूट जाते हैं।
(ii) गलनांक एवं क्वथनांक: आयनिक यौगिकों का गलनांक
एवं क्वथनांक बहुत अधिक होता है क्योंकि मजबूत अंतर-आयनिक आकर्षण को तोड़ने के लिए
ऊर्जा की पर्याप्त मात्रा की आवश्यकता होती है।
(iii) घुलनशीलताः वैद्युत संयोजक यौगिक सामान्यतः जल में घुलनशील
तथा किरोसिन, पेट्रोल
आदि जैसे विलायकों में अविलेय होते हैं।
(iv) विद्युत चालकताः किसी विलयन से विद्युत के चालन के लिए आवेशित
कणों की गतिशीलता आवश्यक होती है। आयनिक यौगिकों के जलीय विलयन में आयन उपस्थित
होते हैं। जब विलयन में विद्युत धारा प्रवाहित की जाती है। तो यह आयन विपरीत
इलैक्ट्रोड की ओर गमन करने लगते हैं।
ठोस अवस्था में आयनिक यौगिक विद्युत का चालन नहीं
करते हैं क्योंकि ठोस अवस्था में दृढ़ संरचना के कारण आयनों की गति संभव नहीं होती
है।
लेकिन आयनिक यौगिक गलित अवस्था में विद्युत का
चालन करते हैं क्योंकि गलित अवस्था में विपरीत आवेश वाले आयनों के मध्य
स्थिरवैद्युत आकर्षण बल ऊष्मा के कारण कमज़ोर पड़ जाता है। इसलिए आयन स्वतंत्र रूप
से गमन करते हैं एवं विद्युत का चालन करते हैं।
प्रश्न
1. (i)
सोडियम, ऑक्सीजन एवं मैग्नीशियम के लिए
इलेक्ट्रॉन-बिंदु संरचना लिखिए।
(ii) इलेक्ट्रॉन के स्थानांतरण के द्वारा Na2O
एवं MgO का निर्माण दर्शाइए।
(iii) इन यौगिकों में कौन से आयन उपस्थित हैं?
2. आयनिक यौगिकों का गलनांक उच्च क्यों होता है?
उत्तर: आयनिक यौगिकों का गलनांक एवं क्वथनांक बहुत
अधिक होता है क्योंकि मजबूत अंतर-आयनिक आकर्षण को तोड़ने के लिए ऊर्जा की पर्याप्त
मात्रा की आवश्यकता होती है।
धातुओं की प्राप्ति:
खनिज : पृथ्वी की भूपर्पटी में प्राकृतिक रूप से पाए जाने वाले तत्वों या
यौगिकों को खनिज कहते हैं।
अयस्क : कुछ स्थानों पर खनिजों में कोई विशेष धातु काफी
मात्रा में होती है जिसे निकालना लाभकारी होता है। इन खनिजों को अयस्क कहते हैं।
धातुओं का निष्कर्षण:
कुछ धातुएँ भूपर्पटी में स्वतंत्र अवस्था में पाई
जाती हैं। कुछ धातुएँ अपने यौगिकों के रूप में मिलती हैं।
सक्रियता श्रेणी में नीचे आने वाली धातुएँ सबसे कम
अभिक्रियाशील होती हैं। ये स्वतंत्र अवस्था में पाई जाती हैं। उदाहरण के लिए, गोल्ड (सोना) , सिल्वर (चाँदी), प्लैटिनम एवं कॉपर (ताँवा) स्वतंत्र
अवस्था में पाए जाते हैं। कॉपर एवं सिल्वर, अपने सल्फाइड या
ऑक्साइड के अयस्क के रूप में संयुक्त अवस्था में भी पाए जाते हैं।
सक्रियता श्रेणी में सबसे ऊपर की धातुएँ (K, Nia, Cu, Mg एवं AI) इतनी अधिक अभिक्रियाशील होती हैं कि ये कभी भी स्वतंत्र तत्व के रूप में
नहीं पाई जातीं।
सक्रियता श्रेणी के मध्य की धातुएँ (Zn, Fe, Pb,आदि) की अभिक्रियाशीलता मध्यम
होती है। पृथ्वी की भू-पर्पटी में ये मुख्यत: ऑक्साइड, सल्फाइड
या कार्बोनेट के रूप में पाई जाती हैं।
अयस्क से शुद्ध धातु का निष्कर्षण कई चरणों में
होता है। इन चरणों का सारांश निम्नलिखित चित्र में दिया गया है।
गैंग (Gungue): पृथ्वी से खनित अयस्कों में मिट्टी, रेत आदि जैसी कई अशुद्धियाँ होती हैं जिन्हें गैंग (Gungue) कहते हैं।
अयस्कों का समृद्धीकरण: धातुओं के निष्कर्षण
से पहले अयस्क से अशुद्धियों (गैंग (Gungue)) को हटाना अयस्कों का समृद्धीकरण कहलाता है।
सक्रियता श्रेणी में नीचे
आने वाली धातुओं का निष्कर्षण सक्रियता श्रेणी में नीचे आने वाली धातुएँ काफ़ी कम
अभिक्रियाशील होती हैं। इन धातुओं के ऑक्साइड को केवल गर्म करने से ही धातु
प्राप्त किया जा सकता है। उदाहरण -
2HgS(s) + 3O2 (g)
2HgO(s) + 2SO2(g)
सिनाबार मक्यूंरिक ऑक्साइड
2HgO(s)
2Hg(l) + O2(g)
मक्यूंरिक ऑक्साइड मर्करी
(पारद)
इसी तरह
2Cu2S + 3O2(g)
2Cu2O(s)
+ 2SO2(g)
2Cu2O + 2Cu2S
6Cu(s) + SO2(g)
सक्रियता श्रेणी के मध्य में स्थित धातुओं का
निष्कर्षण
सक्रियता श्रेणी के मध्य में स्थित धातुएँ (जैसे-आयरन, जिंक,
लेड, कॉपर) की
अभिक्रियाशीलता मध्यम होती है। प्रकृति में यह प्राय: सल्फाइड या कार्बोनेट के रूप
में पाई जाती हैं। सल्फाइड या कार्बोनेट की तुलना में धातु को उसके ऑक्साईड से
प्राप्त करना अधिक आसान है। इसलिए अपचयन से पहले धातु के सल्फाइड एवं कार्बोनेट को
धातु ऑक्साइड में परिवर्तित करना आवश्यक है।
सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप
पर गर्म करने पर यह ऑक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को भर्जन
कहते हैं।
कार्बोनेट अयस्क को सीमित वायु में अधिक ताप पर
गर्म करने से यह ऑक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को निस्तापन
कहा जाता है।
उदाहरण: जिंक के अयस्कों के भर्जन एवं निस्तापन-
थर्मिट
अभिक्रिया:
आयरन(III)ऑक्साईड (Fe2O3) के साथ
ऐलुमिनियम की अभिक्रिया अत्यधिक ऊष्माक्षेपी होती है। इसमें उत्सर्जित ऊष्मा की मात्रा
इतनी अधिक होती है कि धातु (लोहा) गलत अवस्था में प्राप्त होती है। इस
अभिक्रिया को थर्मिट अभिक्रिया कहते हैं।
Fe2O3 (s) + 2Al(s) à 2Fe(l) + Al2O3(s) + ऊष्मा
उपयोग: इसका का उपयोग रेल की पैटरी एवं मशीनी
पुर्जी की दरारों को जोड़ने के लिए किया जाता है।
सक्रियता
श्रेणी में सबसे ऊपर स्थित धातुओं का निष्कर्षण
अभिक्रियाशीलता
श्रेणी में सबसे ऊपर स्थित धातुएँ अत्यंत अभिक्रियाशील होती हैं। इन्हें कार्बन के
साथ गर्म कर इनके यौगिकों से प्राप्त नहीं किया जा सकता है क्योंकि इन धातुओं की बंधुता कार्बन की
अपेक्षा ऑक्सीजन के प्रति अधिक होती है। इन धातुओं को विद्युत अपघटनी अपचयन द्वारा
प्राप्त किया जाता है।
उदाहरण - सोडियम, मैग्नीशियम एवं कैल्सियम को उनके गलत
क्लोराइडों के विद्युत अपघटन से प्राप्त किया जाता है।
कैथोड
(ऋण आवेशित इलेक्ट्रोड) पर धातुएँ निक्षेपित हो जाती हैं
Na+ + e- à Na
तथा
ऐनोड (धन आवेशित इलैक्ट्रोड) पर क्लोरीन मुक्त होती है
2Cl- à Cl2 + 2e-
धातुओं
का परिष्करण
विभिन्न
अपचयन प्रक्रमों से प्राप्त धातुएँ पूर्ण रूप से शुद्ध नहीं होती हैं। इनमें अपद्रव्य होते हैं जिन्हें हटाकर
शुद्ध धातु प्राप्त करना धातुओं का परिष्करण कहलाता है।
विद्युत अपघटनी परिष्करण:
धातुओं से अपद्रव्य को हटाने के लिए यह सबसे अधिक प्रचलित विधि है। कॉपर, जिंक, टिन, निकल, सिल्वर, गोल्ड आदि जैसी अनेक धातुओं का परिष्करण विद्युत अपघटन द्वारा किया
जाता है।
धातु संक्षारण :
धातुओं की सतह का वायु, नमी या रसायनों की क्रिया द्वारा
धीरे धीरे नष्ट हो जाना धातु संक्षारण कहलाता है।
धातु संक्षारण के लिए ऑक्सीजन तथा नमी की आवश्यकता
होती है। इनकी अनुपस्थिति में धातुएँ संक्षारित नहीं होतीं। कुछ निम्न
अभिक्रियाशील धातुएँ जैसे सोना, प्लेटिनम संक्षारित नहीं होती।
धातु संक्षारण के उदाहरण :
1.
सिल्वर की वस्तुएं वायु में पड़े रहने पर काली हो जाती हैं क्योंकि
सिल्वर वायु में उपस्थित सल्फर से अभिक्रिया करके सिल्वर सल्फाइड बनाती है जिससे
सिल्वर की वस्तुएँ काली हो जाती हैं।
2.
कॉपर की वस्तुएँ वायु में हरे रंग की हो जाती हैं क्योंकि कॉपर वायु
में उपस्थित CO2 के साथ अभिक्रिया करके कापर कार्बोनेट बनाती है जिससे इसकी सतह पर हरे रंग
की परत चढ़ जाती है।
3.
जंग-लोहे का संक्षारण जंग कहलाता है। लोहे का संक्षारण एक सतत्
प्रक्रिया है जो सम्पूर्ण वस्तु खत्म होने तक चलती रहती है। लोहे में जंग लगना
संक्षारण का सबसे नुकसानदायक रूप है। जंग का सूत्र Fe2O3. X H2O होता
है।
धातुओं को संक्षारण से बचाने के लिए उपाय:
धातुओं को संक्षारण से बचाने के लिए तेल लगाना, ग्रीस लगाना, पेंट करना, यशदलेपन, कलई करना,
विद्युत-लेपन, मिश्र धातु बनाना आदि अनेक
विधियों का उपयोग किया जाता है.
(a) तेल लगाना-संक्षारण रोकने की यह सबसे पुरानी व सरल
विधि है, जिसमें धातु की सतह पर तेल का लेप । लगाकर उसे नम
वायु के संपर्क में आने से रोकते हैं। चाकू, छुरियाँ,
खेती के औजार व मशीनों आदि को इस विधि द्वारा संक्षारण से बचाते
हैं।
(b) पेंट करना-धातुओं की सतह पर पेंट करके भी उन्हें नम
वायु के संपर्क में आने से रोका जा सकता है तथा धातुएँ संक्षारित नहीं हो पातीं।
इस विधि द्वारा लोहे के पुल, रेल के डिब्बे, मोटर, वाहन आदि को संक्षारण से बचाया जाता है।
(e) विद्युत लेपन-इस विधि द्वारा लोहे और स्टील पर टिन
(कलई) या क्रोमियम जैसी धातुओं की परत चढ़ाकर इनको संक्षारण से सुरक्षित किया जाता
है क्योंकि ये स्वयं संक्षारित नहीं होतीं।
(c) यशदलेपन - यशदलेपन-लोहे की
वस्तुओं को जंग से बचाने के लिए उन पर जिंक धातु की परत चढ़ाने का प्रक्रम यशदलेपन
या गैल्वनीकरण कहलाता है। लोहे की वस्तुओं को पिघली जिंक धातु में डुबो दिया जाता
है जिससे वस्तु पर जिंक रक्षक परत चढ़ जाती है जो इसे जंगीकृत होने से बचाती है।
(d) मिश्रधातु - किसी धातु का किसी अन्य धातु या अधातु
से समांगी मिश्रण मिश्रधातु कहलाता है। मिश्रधातु संक्षारण की प्रतिरोधी होती है
ये संक्षारित नहीं होती। इस प्रकार प्राप्त धातु के गुण, मूल
धातु के गुणों से अलग होते हैं। उदाहरण-(1) पीतल (ii)
काँसा (iii) टाँका
विभिन्न मिश्रित धातुएँ और इनके संघटक:
1. पीतल - तांबा (75%) + जस्ता (25%)
2. घंटा धातु (Bell metal) - तांबा (75%) + टिन (25%)
3. कांसा - तांबा (75%) + टिन (25%)
4. जर्मन सिल्वर - तांबा (50%) + जस्ता (25%) +
निकेल (25%)
5. एल्युमीनियम कांसा- तांबा (50%) एल्युमीनियम
(40%) + लोहा (10%)
6. गन मेटल - तांबा (88%) + जस्ता (2%) + टिन (10%)
7. स्टेनलेस स्टील - लोहा + क्रोमियम + निकेल
8. टांका (solder) - टिन (67 प्रतिशत) + सीसा (33 प्रतिशत) [इसे
तारों की परस्पर वैल्डिंग करने के लिए प्रयोग किया जाता है। ]
9. मैग्नेलियम (Magnalium) - इसमें ऐल्युमिनियम 95-70 प्रतिशत तथा
मैग्नीशियम 5-30 प्रतिशत तक होता है।
10. नाइक्रोम (Nichrome) - इसमें निकल 80-54, क्रोमियम
10-22, लोहा 4.8-27 प्रतिशत तक होते हैं।
अमलगम - पारा धातु की किसी अन्य धातु के साथ मिश्रण से
प्राप्त हुई मिश्रधातु अमलगम कहलाती है। चाँदी, टिन तथा जिंक जैसी धातुओं से बने अमलगम दाँतों के
छिद्र भरने के काम आता है।
प्रश्न . 24 कैरेट गोल्ड क्या होता है? इसको
आप 18 कैरेट गोल्ड में किस प्रकार से परिवर्तित कर सकते हैं?
उत्तर- शुद्ध सोना 24 कैरेट वाला होता है। 24 कैरेट
गोल्ड बहुत कोमल और नर्म होता है, जिससे आभूषण नहीं बनाए
जाते हैं। सोने को कठोर बनाने के लिए इसमें ताँबा या चाँदी मिलाया जाता है। आभूषण
बनाने के लिए प्रायः 22 कैरेट सोना प्रयोग करते हैं। 18
कैरेट गोल्ड प्राप्त करने के लिए 18 भाग सोने
में 6 भाग ताँबा या चाँदी मिलाते हैं।
प्रश्न अभ्यास
प्रश्न 1. निम्न में कौन-सा युगल विस्थापन अभिक्रिया
प्रदर्शित करता है :
(a) NaCl विलयन एवं कॉपर धातु
(b) MgCl2 विलयन एवं ऐलुमिनियम धातु
(c) FesO4 विलयन एवं सिल्वर धातु
(d) AgNO3 विलयन एवं कॉपर धातु
उत्तर- (d) AgNO3 विलयन एवं कॉपर धातु ।
प्रश्न 2. लोहे के फ्राइंग पैन (frying pan) को जंग से बचाने के लिए निम्न में से कौन-सी विधि उपयुक्त है :
(a) ग्रीस लगाकर
(b) पेंट लगाकर
(c) जिंक की परत चढ़ाकर
(d) ऊपर के सभी
उत्तर-(c) जिंक की परत चढ़ाकर।
प्रश्न 3. कोई धातु ऑक्सीजन के साथ अभिक्रिया कर उच्च गलनांक
वाला यौगिक निर्मित करती है। यह यौगिक जल में विलेय है। यह तत्त्व क्या हो सकता है?
(a) कैल्सियम
(b) कार्बन
(c) सिलिकन
(a) लोहा
उत्तर- (a). कैल्सियम, ऑक्सीजन के साथ
क्रिया करके आयनिक यौगिक बनाता है जिसका गलनांक उच्च होता है।
प्रश्न 4. खाद्य पदार्थ के डिब्बों पर जिंक की बजाय टिन का
लेप होता है क्योंकि
(a) टिन की अपेक्षा जिंक महँगा है।
(b) टिन की अपेक्षा जिंक का गलनांक अधिक है।
(c) टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है।
(d) टिन की अपेक्षा जिंक कम अभिक्रियाशील है।
उत्तर-(c) टिन की अपेक्षा जिंक अधिक अभिक्रियाशील है।
प्रश्न 5. आपको एक हथौड़ा, बैटरी,
बल्ब, तार एवं स्विच दिया गया है : (a)
इनका उपयोग कर धातुओं एवं अधातुओं के नमूनों के बीच आप विभेद कैसे कर
सकते हैं? (b) धातुओं एवं अधातुओं में
विभेदन के लिए इन परीक्षणों की उपयोगिताओं का आकलन कीजिए।
उत्तर- (a)
(i) हथौड़े के उपयोग द्वारा-दिए गए पदार्थ को हथौड़े से
पीटने पर यदि यह पदार्थ चादर के रूप में बदलने लगे तो धातु होगा, परंतु हथौड़े से पीटने पर यह टूट जाए तो अधातु होगा।
(ii) बैटरी, बल्ब, तार, स्विच द्वारा चित्रानुसार एक परिपथ तैयार करो।
दिए गए पदार्थ को क्लिप से जोड़कर स्विच ऑन करो। यदि बल्ब जलता है, तो दिया गया पदार्थ धातु है, क्योंकि धातुएँ विद्युत
की सुचालक होती हैं। परंतु यदि दिया गया पदार्थ लगाने पर बल्ब नहीं जलता है तब वह
अधातु होगा क्योंकि अधातुएँ विद्युत की कुचालक होती हैं।
(b) उपरोक्त दोनों ही परीक्षण धातु एवं अधातु में
विभेदन के लिए उपयोगी हैं। धातुएँ आघातवर्थ्य तथा विद्युत की सुचालक होती हैं जबकि
अधातुएँ भंगुर तथा विद्युत की कुचालक होती है।
प्रश्न 6. उभयधर्मी ऑक्साइड क्या होते हैं? दो उभयधर्मी ऑक्साइडों का उदाहरण दीजिए।
उभयधर्मी ऑक्साइड - ऐसे धातु ऑक्साइड जो अम्ल तथा क्षारक दोनों से अभिक्रिया करके लवण
तथा जल प्रदान करते हैं, उभयधर्मी ऑक्साइड कहलाते हैं। उदाहरण: ऐलुमिनियम ऑक्साइड, जिंक ऑक्साइड।
अम्ल तथा क्षारक के साथ ऐलुमिनियम ऑक्साइड निम्न
प्रकार से अभिक्रिया करता है।
Al2O3
+ 6HCI → 2AICI3 + 3H2O
Al2O3+
2NaOH → 2NaAlO2 + H2O
सोडियम ऐलुमिनेट
प्रश्न 7. दो धातुओं के नाम बताइए जो तनु अम्ल से हाइड्रोजन
को विस्थापित कर देंगी तथा दो धातुएँ जो ऐसा नहीं कर सकती हैं।
उत्तर- (i) हाइड्रोजन से अधिक अभिक्रियाशील धातुएँ अम्ल से
हाइड्रोजन विस्थापित कर सकती हैं- जैसे सोडियम (Na), जिंक (Zn)
आदि
(ii) हाइड्रोजन से कम अभिक्रियाशील धातुएँ अम्ल से
हाइड्रोजन विस्थापित नहीं कर सकती – जैसे कॉपर (Cu) तथा सिल्वर
(Ag)
प्रश्न 8. किसी धातु M के विद्युत
अपघटनी परिष्करण में आप ऐनोड, कैथोड एवं विद्युत अपघट्य किसे
बनाएँगे?
उत्तर- ऐनोड- धातु M की अशुद्ध प्लेट
कैथोड-
धातु M की शुद्ध
प्लेट
अपघट्य-
धातु M का जलीय
विलयन।
प्रश्न 9. प्रत्यूष ने सल्फर चूर्ण को स्पैचुला में लेकर उसे
गर्म किया। चित्र के अनुसार एक परखनली को उल्टा करके उसने उत्सर्जित गैस को एकत्र
किया
(a) गैस की क्रिया क्या होगी।
(i) सूखे लिटमस पत्र पर?
(ii) आर्द्र लिटमस पत्र पर?
(b) ऊपर की अभिक्रियाओं के लिए संतुलित रासायनिक
अभिक्रिया लिखिए।
उत्तर- (a) सल्फर, ऑक्सीजन से अभिक्रिया
करके सल्फर डाइऑक्साइड बनाती है।
S + O2 à SO2(g)
(i) सूखे लिटमस पेपर पर गैस कोई क्रिया नहीं करती।
(ii) गैस आर्द्र लिटमस पेपर पर उपस्थित जल से अभिक्रिया
करके सल्फ्यूरस अम्ल बनाती है, जो नीले लिटमस को लाल कर देता
है।
(b) SO2(g) + H2O à H2SO4(aq)
सल्फर
डाइऑक्साइड़ जल सल्फ्यूरस अम्ल
प्रश्न 10. लोहे को जंग से बचाने के दो तरीके बताइए।
उत्तर: विद्यार्थी स्वयं प्रयास करें।
प्रश्न 11. ऑक्सीजन के साथ संयुक्त होकर अधातु कैसा ऑक्साइड
बनाते हैं?
उत्तर- अधातुएँ ऑक्सीजन के साथ संयुक्त होकर अम्लीय तथा उदासीन दो प्रकार
के ऑक्साइड बनाती हैं।
उदाहरण- S + O2 à SO2(g) (अम्लीय ऑक्साइड)
2H2(g) + O2 g) → 2H2O(l)
(उदासीन ऑक्साइड)
प्रश्न 12. कारण बताइए :
(a) प्लैटिनम, सोना एवं चाँदी का
उपयोग आभूषण बनाने के लिए किया जाता है।
(b) सोडियम, पोटैशियम एवं लीथियम
को तेल के अंदर संग्रहित किया जाता है।
(c) ऐलुमिनियम अत्यंत अभिक्रियाशील धातु है, फिर भी इसका उपयोग खाना बनाने वाले बर्तन बनाने
के लिए किया जाता है।
(d) निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड
अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
उत्तर (a) प्लैटिनम,
सोना एवं चाँदी का उपयोग आभूषण बनाने के लिए किया जाता है क्योंकि
ये तीनों ही धातुएँ आसानी से संक्षारित नहीं होतीं तथा साथ ही ये धातुएँ ये आघातवर्थ्य, तन्य व चमकदार भी होती हैं।
(b) सोडियम, पोटैशियम तथा लीथियम काफी
अधिक अभिक्रियाशील धातुएँ हैं, जिस कारण ये कक्ष ताप पर वायु
तथा जल से अभिक्रिया कर लेती हैं। अतः उन्हें अभिकृत होने से बचाने के लिए मिट्टी
के तेल में डुबोया जाता है।
(c) ऐलुमिनियम अत्यन्त अभिक्रियाशील धातु है फिर भी
इसका उपयोग खाना बनाने वाले बर्तन बनाने में किया जाता है क्योंकि वायु के सम्पर्क
में आने से इस धातु पर ऐलुमिनियम ऑक्साइड (Al2O3) की परत चढ़ जाती है जिससे यह संक्षारित होने से बच जाती है। साथ ही यह एक
सस्ती धातु है।
(d) क्योंकि धातु कार्बोनेटों तथा धातु सल्फाइडों से
सीधे धातु प्राप्त करना कठिन होता है। जबकि धातु ऑक्साइडों से अपचयन द्वारा धातु
प्राप्त करना आसान होता है इसलिए निष्कर्षण प्रक्रम में कार्बोनेट एवं सल्फाइड
अयस्क को ऑक्साइड में परिवर्तित किया जाता है।
प्रश्न 13. आपने ताँबे के मलिन बर्तन को नींबू या इमली के रस
से साफ करते अवश्य देखा होगा। यह खट्टे पदार्थ बर्तन को साफ करने में क्यों
प्रभावी हैं?
उत्तर- ताँबे के बर्तनों की सतह खुली वायु में रहने से इन पर धातु ऑक्साइड
की परत चढ़ जाती है, जिससे ये बर्तन मलिन नजर आते हैं। इन्हें साफ करने के लिए नींबू, इमली जैसे पदार्थों का उपयोग किया जाता है क्योंकि इनमें सिट्रिक अम्ल
होता है जो बर्तन पर चढी धातु ऑक्साइड की परत को हटाकर उन्हें पुनः चमकदार बना
देता है।
प्रश्न 14. रासायनिक गुणधर्मों के आधार पर
धातु एवं अधातु में विभेद करो।
उत्तर- रासायनिक गुणधर्मों के आधार पर धातु एवं
अधातुओं में अन्तर निम्न प्रकार से है|
धातु
|
अधातु
|
1. धातुएँ ऑक्सीजन से क्रिया करके क्षारीय ऑक्साइड ऑक्साइड
बनाती हैं।
2. अधिक अभिक्रियाशील धातुएँ अच्छी अपचायक होती हैं।
3. अभिक्रियाशील धातुएँ अम्लों से हाइड्रोजन
विस्थापित करके हाइड्रोजन गैस बनाती हैं।
4. धातुएँ जलीय विलयन में धनायन बनाती हैं।
5. धातुएँ क्लोरीन से संयोग करके धातु क्लोराइड
बनाती हैं जो आयनिक यौगिक होते हैं।
|
1. धातुएँ ऑक्सीजन से क्रिया करके अम्लीय या उदासीन
आक्साइड बनाती हैं।
2. अधातुएँ अच्छी उपचायक होती हैं।
3. अधातुएँ अम्लों से हाइड्रोजन विस्थापित नहीं
करती।
4. अधातुएँ जलीय विलयन में ऋणायन बनाती हैं।
5. अधातुएँ क्लोरीन से संयोग करके अधातु क्लोराइड
बनाती हैं जो सहसंयोजी यौगिक होते हैं।
|
प्रश्न 15. एक व्यक्ति प्रत्येक घर में सुनार बनकर जाता है।
उसने पुराने एवं मलिन सोने के आभूषणों में पहले जैसी चमक पैदा करने का ढोंग रचाया।
कोई संदेह किए बिना ही एक महिला अपने सोने के कंगन उसे देती है जिसे वह एक विशेष
विलयन में डाल देता है। कंगन नए की तरह चमकने लगते हैं लेकिन उनका वजन अत्यंत कम
हो जाता है। वह महिला बहुत दुखी होती है तथा तर्क-वितर्क के पश्चात् उस व्यक्ति को
झुकना पड़ता है। एक जासूस की तरह क्या आप उस विलयन की प्रकृति के बारे में बता
सकते हैं?
उतर - सुनार बनकर गए व्यक्ति द्वारा प्रयोग किया गया विलयन एक्वारेजिया
है। ऐक्वारेजिया विलयन में सोना घुलनशील है। ऐक्वारेजिया तनु हाइड्रोक्लोरिक अम्ल
एवं नाइट्रिक अम्ल का 3 : 1 का विलयन होता है। इसलिए उस महिला के कगनों का वजन कम हो जाता है।
प्रश्न 16. गर्म जल का टैंक बनाने में ताँबे का उपयोग होता है
परंतु इस्पात ( लोहे की मिश्रातु) का नहीं। इसका कारण बताइए।
उत्तर- तांबा इस्पात की अपेक्षा अच्छा ऊष्मा का सुचालक होता है जिस कारण
कॉपर के प्रयोग से ऊर्जा की बचत होती है। दूसरी ओर कॉपर उच्च ताप भी पर जल से
क्रिया नहीं करता जबकि लोहा गर्म करने पर जल से क्रिया करके Fe3O4(aq)
बनाता है।













Comments
But it's not working well.